Sunday, November 05, 2006
molecular cloning: banding大量高純度的質體DNA
接下來因應實驗者對質體DNA在數量和純度上的需求,介紹一種稱為”Banding”的質體DNA的抽取方法。所謂的banding是將質體DNA透過高密度介質氯化銫(CsCl)在超高速離心(ultracentrifuge)下形成分離,質體DNA在超高速離心的氯化銫中形成單一個帶狀故名。因為培養細菌的種類和時程會影響最後質體DNA的產量,故以下以一般實驗室常用的菌種XL1-Blue,吃入質體DNA含Amp選質基因為例,根據實驗時間來依序介紹。
(一)第一天下午五點將單珠菌種移植到3 ml的LB培養液(A+T:使用前加入tetracycline:12.5 ug/ml與ampicilin:50 ug/ml),準備或預借之後所需的實驗材料如下:
滅好菌的LB培養液(500 ml/construct)
測OD值所需比色管
Beckman GSA 10 rotor離心用的250 ml離心管( 兩支 /construct :檢查每支管子的O-ring是否完好)
Chloramphenicol(34 mg/ml:in pure ethanol;2.5 ml/construct)
Solution 1(30 ml /construct)
Solution 2(60 ml /construct)
Solution 3(45 ml /construct)
乾淨的紗布數塊
Isopropanolol(0.6倍體積約81 ml /construct)
1xTE(溶解DNA用,pH=8.0、20 ml /construct)
7.5M Ammonium acetate(4 ml /construct)
Beckman SS-34 rotor與其50 ml離心管(兩支 /construct)
100%酒精(30 ml /construct)
RNase A(10 ul /construct)
CsCl(10 g /construct)
Beckman ultracentrifuge用rotor NVT-65、蓋子(cap)、cap封口把手(有磅數指針)、原廠離心管及封口 焊鐵(見附錄一)
1 ml、5 ml注射針數支、18號、21號針頭、一般15 ml離心管
EtBr(1 ml /construct)
手提式紫外光燈
l-butanol(pure & saturated:含水)
透析用DNA袋子、夾子和裝4公升TE溶液的容器,stir bar等....
(二)第二天上午11點將3 ml的菌液取1 ml加到500 ml的 LB培養液(A+T),再放回培養箱進行培養。9~10小時之後進行菌液OD值比色,以乾淨的LB( A+T)為基準做校正,確定細菌生長週期達到plateau(OD值約0.8~1.0之間)。此時加入2.5 ml的 Chloramphenicol(final concentration=170 ug/ml), 再放回培養箱養16小時 。Chloramphenicol的作用在於使細菌停止細胞複製,儘量製造更多的質體DNA,。
(三)第三天下午2點回收細菌,將菌液分裝到250 ml的離心管內,進行4500 rpm(Beckman GSA 10 rotor)、4度C離心20分鐘。倒掉上清液留下下方的pellet,敲打試管或vortex使pellet完全散開,再依序加入S1 30 ml,invert數次,靜置室溫15分鐘;S2 60 ml, gently invert數次,靜置冰上15分鐘;S3 45 ml, gently invert數次, 靜置冰上15分鐘。之後進行5000 rpm(GSA 10 rotor)、4度C離心20分鐘。
(四) 以雙層紗布過濾上清液到另一個乾淨的250 ml離心管,如過濾不乾淨可考慮重覆離心、紗布過濾兩次,確定過濾後的液體澄清,沒有白色沈積物。再加入0.6倍體積的 Isopropanolol(約81 ml), invert數次,靜置冰上15分鐘。之後4度C離心5000 rpm(GSA 10 rotor)20分鐘,倒掉上清液,這時可見瓶底有透明pellet,倒扣瓶子Dry乾液體數分鐘,加入10 ml TE搖晃均勻,最後將10 ml液體(增加回收率可以分4、3、3 ml三次)放到新的50 ml離心管(for SS-34 rotor)。
(五) 加入4 ml 的7.5M Ammonium acetate, 搖晃均勻後靜置冰上10分鐘,4度C離心4500 rpm(SS-34 rotor)10分鐘,此時下方pellet為殘留的細菌染色體與蛋白質,取上清液到新的50 ml離心管(for SS-34 rotor),加入30 ml 100%的酒精,放置負20度C冰箱至少兩小時;再離心 4度C離心10000 rpm(SS-34 rotor)40分鐘;到掉上清液,真空45度C dry乾1小時(可使用保鮮膜封口再行戳洞),之後加蓋保存負20度C冰箱。
(六)解凍後加入10 ml TE溶解下方pellet(增加回收率可以分4、3、3 ml三次),將溶好DNA的TE移到新的15 ml離心管(先取出5 ul當控制組),加入10 ul的RNase A,37度C作用1小時,取5 ul run gel(這步驟可以檢視RNase A是否將RNA清除乾淨)。
(七)精秤CsCl 10克(誤差再0.001g之內)放入50 ml的離心管,將10 ml的TE加入,搖晃至粉末全部溶解;再用5 ml針筒將液體全部加入 Beckman ultracentrifuge 專用離心管( NVT-65 rotor專用),加入時液體由管壁緩慢留下,眼睛檢視絕對不可以有氣泡產生。之後用1 ml針筒將EtBr(有毒物質請小心操作!)加入約0.7~1.0 ml,因為上超高速離心一定要兩邊試管重量相等,所以後果不堪設想!所以加入EtBr的質量提供平衡兩試管重量的好機會(平衡的兩試管誤差應小於0.01克),方可上超高速離心機。
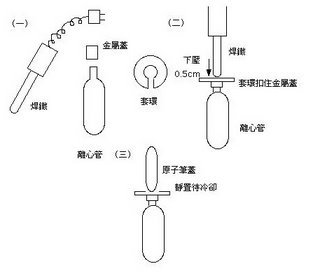
(八)小心用Beckman原廠焊鐵封口(見左圖),封口後可以用手用力壓壓看測試是否完整。封口後invert數下,使EtBr混合均勻,包覆錫泊紙以阻絕光線。上機前在確定兩試管重量相等,方可進行超高速離心。 NVT-65 的 rotor 每支離心管都要加 Cap(with O-ring),用原廠把手鎖緊,確定扭力磅秤讀數約120磅,上機進行超高速離心,離心參數為 20度C、65000 rpm 6小時。
(九)解開 Cap,小心翼翼(勿晃動)將離心管用夾子抽出,鋪好bench紙,打開紫外光燈,此時可見三條主要亮帶(見下圖)先用21號針頭由離心管上方插入(release pressure),在用18號針頭、5 ml針筒由質體DNA的band下方刺入離心管,抽出橘紅色液體約1~2 ml(吸取時可旋轉針頭),放到新的15 ml離心管。

(十)用dropper取兩倍體積(約4 ml)的 Saturated l-butanol(含水),invert混合均勻後室溫離心2000 rpm、3分鐘,用dropper吸掉上清液;再用dropper取兩倍體積(約4 ml)的 Pure l-butanol(不含水), invert混合均勻後室溫離心2000 rpm、3分鐘,用dropper吸掉上清液,這步驟可以去掉大部分的EtBr,準備乾淨的dialysis bag,將質體DNA用p1000移進袋子裡,放到4公升的TE中進行透析,此過程在4度C冰箱中進行,將裝好TE的桶子放在電磁攪拌器上,下方stir bar維持旋轉,6~8小時更換一次乾淨的TE,如此重複3~4次。